chILD-EU Projekt
Das europäische Netzwerk-Projekt chILD-EU wurde im Rahmen des 7. Forschungsrahmenprogramms von Dezember 2012 bis November 2016 von der Europäischen Kommission gefördert.
Im Projekt wurde die europäische Management Plattform mit chILD Register und Biobank aufgebaut. Diese Struktur dient weiterhin als Grundlage für fortgesetzten Projekte zur Förderung und Verbesserung der Diagnostik und Therapiemöglichkeiten interstiteller Lungenerkrankungen im Kindesalter.
Weitere Informationen für Kliniker/Forscher:
-Publication Guidelines (pdf)
Überblick GOLDnet
Ziele des GOLD.net
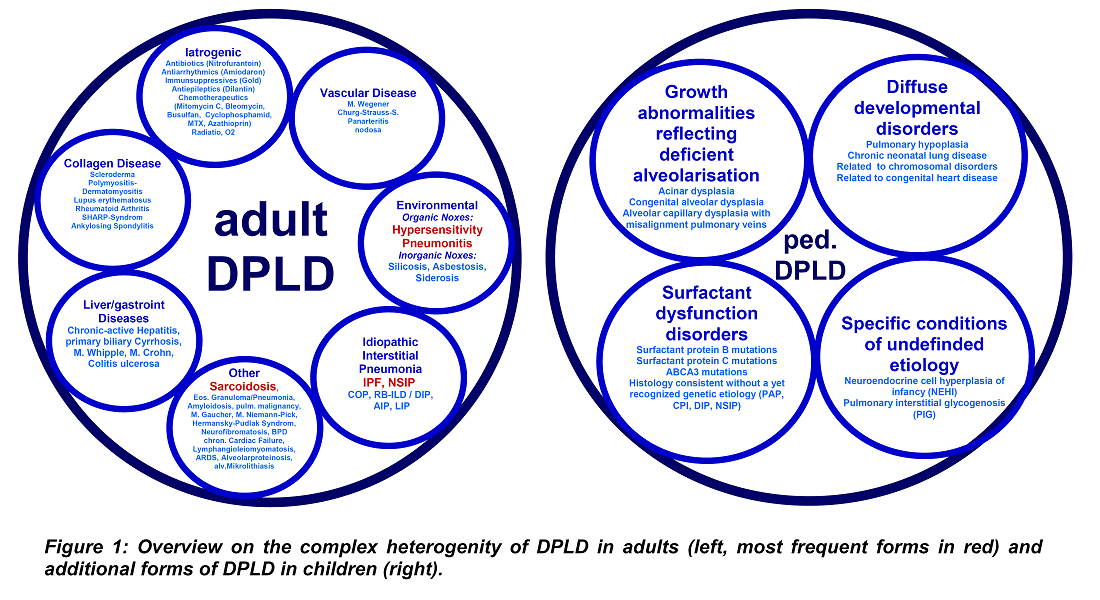
Interstitielle Lungenerkrankungen (DPLD) sind eine heterogene Gruppe an Erkrankungen mit mehr als 100 unterschiedlichen Entitäten, welche sich in den zugrunde liegenden Auslösern unterscheiden, aber Folge der Entwicklung einer Lungenfibrose teilen. Da die Auslöser bisher weitgehend unbekannt sind, beschränken sich die Behandlungsoptionen auf Kortikosteroide und Immunsuppressiva, sind häufig ineffizient und ein letztendlich fataler Ausgang ist die Regel. Die translationale Forschung auf diesem Gebiet ist unangemessen gering, teilweise bedingt durch die sehr begrenzte Verfügbarkeit gut definierter Patientenkohorten mit Biomaterialien. Aus diesem Grund hat das Deutsche Netzwerk für interstitielle Lungenerkankungen ein Register mit Biobank für adulte und pädiatrische DPLD etabliert. Dieses Register erlaubt die Beschreibung des natürlichen Verlaufs, die Verbesserung der diagnostischen Standards für DPLD und bietet äußerst wertvolle Biomaterialien für translationale Forschung zur Identifikation von Auslösemechanismen, zellülären Abläufen, profibrotischen Signaltransduktionswegen und modifizierenden Signalwegen, welche der Entwicklung der Lungenfibrose in DPLD zugrunde liegen, sowie die Etablierung neuer diagnostischer Teste und Tiermodelle, sowie die Evaluation neuer Behandlungsoptionen. Auf lange Zeit gesehen erwarten wir das unsere Arbeit in einem besseren Verständnis der molekularen Mechanismen, verbesserter Diagnostik und neuen Behandlungsoptionen für Patienten mit DPLD mündet.
GOLD Register und Biobank
Interstitielle Lungenerkrankungen (DPLD) sind eine heterogene Gruppe seltener Erkrankungen, welche zusammen genommen eine große Gruppe Patienten aller Alterklassen umfassen und welche durch eine hohe Morbidität und Mortalität charakterisiert sind. Aufgrund der Seltenheit sind diese Patienten schwer zu diagnostizieren und schwer zu behandeln, aber auch schwer zu erforschen. Aus diesem Grund hat das Deutsche Netzwerk für interstitielle Lungenerkrankungen (GOLD.net) ein Register zur Sammlung klinischer Dater aller Formen von DLPD bei Kindern und Erwachsenen implementiert. Gesammelt werden alle relevanten Informationen zur Anamnese, zu klinischen Untersuchungsbefunde, radiologische, histopathologische und zytologische Untersuchungen, Komorbiditäten, zur Medikation, sowie Verlaufsdaten. Die Diagnose wir durch ein Expertengremium verifiziert, welches dem behandelnden Arzt Rückmeldung gibt. Anhand der übermittelten Daten sollen wichtige Fragestellungen bezüglich diagnosischer Verfahren und Verlauf von adulten und pädiatrischen DPLD beantwortet werden.
Infolge der Teilung medizinischer Expertise in adulte und pädiatrische DPLD-Spezialisten/Experten wird das Register aus zwei Subregistern bestehen, eines für die pädiatrischen und eines für die adulten DPLD. Diese Teilung wird den spezifischen Anforderungen der einzelnen Expertise gerecht, wobei die Ergebnisse am Ende gemeinsam untersucht und ggf. übergreifende Schlussfolgerungen gezogen werden.
Ethik und Datenschutz - KLR
a) Konsiliarfall
Ein Behandler wendet sich im Rahmen des Behandlungszusammenhanges (das Einverständnis des Patienten vorausgesetzt) an ein Zentrum des Kinderlungenregisters/GOLD.net, um Beratung bzgl. Diagnostik oder Therapie eines Patienten zu erhalten und den Patienten nach Abschluss der Diagnostik pseudonymisiert in das Register aufzunehmen, so greift in diesem Fall das lokale Ethikvotum des Zentrums. Voraussetzung für die Zusammenarbeit von Zentrum und Behandler ist die Zustimmung zu den Kooperationsvereinbarungen, welche den Umgang mit dem KLR/GOLD.net und dem Data Capture Tool, sowie die Datensicherheit regeln. Jedes aktive Zentrum des KLR/GOLD.net muss einen Ethikantrag an seine lokale Ethikkommission stellen. Mindestens einmal pro Jahr muss jedes Zentrum neue Behandler, welche im oben beschriebenen Behandlungszusammenhang Patienten in das Register einbringen, der lokalen Ethikkommission melden.
Die Kommunikation zwischen Behandler und den Experten des Registers erfolgt ausschließlich über das Data Capture Tool des Registers, welches den aktuellen Anforderungen der Datensicherheit entspricht. Es erfolgt kein direkter Kontakt zwischen Patient und Zentrum. Falls notwendig, kann das Zentrum den Behandler kontaktieren, der ggf mit dem Patienten Kontakt aufnimmt.
b) Registerfall
Bringt ein Behandler eigenständig, d. h. ohne Behandlungszusammenhang (keine Beratung bzgl. Diagnostik und Therapie) abgeschlossene, diagnostizierte Fälle, das Einverständnis des Patienten vorausgesetzt, pseudonymisiert in das Register ein, so gilt er als "Zentrum" und muss bei seiner lokal zuständigen Ethikommission einen Ethikantrag stellen. Die Experten des Kinderlungenregister arbeiten (mit gewisser zeitlicher Verzögerung) zur Qualitätssicherung die Fälle zur Überprüfung der gestellten Diagnose durch.
Jegliche Kommunikation zwischen dem Behandler und dem Register erfolgt ebenfalls über das Data Capture Tool des Registers. Ein direkter Kontakt zwischen Register und Patient kann und wird nicht erfolgen.
c) Klinische Studien
Klinische Studien die im Rahmen des KLR aufgelegt werden oder an denen das KLR teilnimmt erfordern jeweils ein separates Ethikvotum. Sollte ein Patient für die Teilnahme an einer klinischen Studie in Frage kommen, wird sein Behandler hierüber in Kenntnis gesetzt. Dieser kann dann Kontakt zum Patienten aufnehmen.
Datenschutz und Ethik-Begutachtung
Das Datenschutzkonzept und die Ethikanträge für die laufende Arbeit des Registers und der Biobank sind positiv votiert worden und können in diesem Verzeichnis eingesehen werden. Gerne sind wir bei ggf notwendigen Antragstellungen behilflich.
Alle Kinder mit DPLD (= ILD)
1. Alle diffus parenchymatösen Lungenerkrankungen (DPLD), auch interstitielle Lungenerkrankungen genannt, sollten wegen ihrer Seltenheit im Register gesammelt und im Langzeitverlauf beobachtet werden.
Die einzelnen Erkrankungen sind in Tab. 1 gelistet.
Die aktuelle Klassifikation findet sich hier.
2. Ferner sollten alle Kinder, die eine diagnostische Lungenbiopsie bekommen, eingeschlossen werden.
Tab. 1 Listung der ins Register einzuschließenden Diagnosen. Selbstverständlich können gerne Kinder mit Diagnosen, die nocht nicht genannt sind eingeschlossen werden.
| A1 DPLD-Diffuse developmental disorders |
| Acinar dysplasia |
| Alveolar capillary dysplasia (ACD) with misalignment pulmonary vein |
| Alveloar capillary dysplasia, no misalignment of pulm.veins (event. + anoph-thalmia, cong. heart disease, diaph. hernia, lung hypoplasia, ment. retard. |
| Congenital alveolar dysplasia |
| A2 DPLD-Growth abnormalities reflecting deficient alveolarisation |
| Intrauterine growth retardation (alcohol) |
| Pulmonary hypoplasia |
| Pulmonary hypoplasia associated with diagphragmatic hernia |
| Related to chromosomal disorders |
| Related to congenital heart disease |
| Related to preterm birth (BDP-cLDI) |
| Related to preterm birth (Wilson Mikity, new BPD) |
| A3 DPLD-Infant chronic tachypnoe and firm morphology |
| Chronic tachypnoe of infancy (CTI) |
| Neuroendocrine cell hyperplasia of infancy (NEHI) |
| Pulmonary interstitial glycogenosis (PIG) |
| A4 DPLD–related to alveolar surfactant region |
| ABCA3 mutations 1 |
| ABCA3 mutations 2 |
| Alveolar microlithiasis |
| Chronic pneumonitis of infancy (CPI) |
| Desquamative interstitial pneumonitis (DIP) |
| Lipoidpneumonitis, Cholesterol pneumonia |
| Nkx21 gene defect |
| Nonspecific interstitial pneumonia (NSIP) |
| NSIP+PAP+Microvasulopathie |
| Pulmonary alveolar proteinosis (PAP), adult NO GMCSF autoantibodies |
| PAP, adult with GMCSF autoantibodies |
| PAP, juvenile |
| PAP, neonatal |
| PAP, secondary to associated disease |
| PAP+DIP+cholesterin granulomas |
| Surfactant protein B mutations |
| Surfactant protein C mutations |
| Usual interstitial pneumonitis |
| Cryptogenic Organizing Pneumonia (Bronchiolitis Obliterans Organizing Pneumonia) |
| Diffuse Alveolar Damage and Acute Interstitial Pneumonia |
| Acute Fibrinous and Organizing Pneumonia |
| Respiratory Bronchiolitis-Interstitial Lung Disease |
| Ax DPLD-unclear RDS in the mature neonate |
| to be determined |
| Familial |
| No or very low SP-C biochemically |
| No SP-B biochemically |
| Pulmonary hypertension |
| Ay DPLD-unclear RDS in the almost (30-36 wks) mature neonate |
| Familial |
| No or very low SP-C biochemically |
| No SP-B biochemically |
| Pulmonary hypertension |
| B1 DPLD-related to systemic disease processes |
| Achondroplasie, zB Cartilage-Hair Hypoplasia |
| Familial dysautonomia (Chromosome 9q31 encoding ICAP) |
| Familial ILD, growth defic., hepatopathy, normal psychomotor development, triventri.hydrocephalus |
| Hermansky-Pudlak Syndrome |
| Hoyeral Hreidasson Syndrom (Dyskeratosis congenita) |
| Immune-mediated/collagen vascular disorders |
| Diffuse alveolar hemorrhage due to vasculitic disorders |
| Idiopathic pulmonary hemosiderosis |
| Antibasement Membrane Antibody Disease (Good pasture’s Syndrome) |
| Lymphangioleiomyomatosis (LAM) |
| Erdheim-Chester Disease |
| Langerhans cell histiocytosis |
| Sinus Histiocytosis with Massive Lymphadenopathy |
| Churg-Strauss Syndrome |
| Microscopic Polyangiitis |
| Necrotizing Sarcoid Granulomatosis |
| Other Rare Causes of Granulomatous Arteritis |
| Giant Cell Arteritis |
| Disseminated Visceral Giant Cell Angiitis |
| Polyarteritis Nodosa |
| Takayasu's Arteritis |
| Behcet's Syndrome |
| Blau Syndrome (polyarthritis, uveitis, papuloerythematous rash) + rarely lung. |
| Sarcoidosis |
| Storage diseases |
| Wegener Granulomatosis |
| B2 DPLD-in the presumed immune intact host, related to exposures (infectious/non-infectious) |
| Aspiration syndromes |
| Central hypoventilation syndrome (Ondine) |
| Congenital muscle disease |
| Eosinophilic pneumonitis |
| Exogen allergic alveolitis/hypersensitivity pneumonitis |
| Infectious/post-infectious processes |
| Mac-Leod-Swyer-James-Syndrom |
| Drug Reactions |
| Occupational Lung Diseases and Pneumoconioses |
| Radiation Lung Injury |
| Toxic inhalation |
| B3 DPLD-in the immunocompromised host or transplanted |
| Diffuse lung damage of unknown etiology |
| Infections–Antibody deficiencies |
| Infections–Miscellaneous |
| Infections–Phagocyte defects |
| Infections–T cell deficiencies |
| Related to therapeutic intervention |
| Related to transplantation and rejection |
| B4 DPLD-related to lung vessels structural processes |
| Arterial hypertensive vasculopathy (Primary pulmonary hypertension Chr 2q33) |
| Congestive changes related to cardiac dysfunction |
| Lymphatic disorders |
| M. Osler |
| Pulmonary capillary hemangiomatosis |
| Pulmonary hemorrhage |
| Pulmonary hemorrhage due to infection |
| Pulmonary hypertension |
| Veno-occlusive disease |
| B5 DPLD-related to reactive lypmphoid lesions |
| Follicular bronchitis/bronchiolits |
| Giant lymphnode hyperplasia (Castleman´s disease) |
| Intrapulmonary lymph nodes |
| Lymphocytic interstitial pneumonia (LIP) |
| Nodular lymphoid hyperplasia of the lung |
| Bx DPLD-unclear RDS in the NON-neonate |
| to be determined |
| Familial |
Ethik und Datenschutz - GOLDnet
Die Fälle des Kinderlungenregisters wurden bis 2013 im GOLDnet Projekt geführt.
Die federführende Ethikkommission der Universität Giessen hat den Ethikantrag des GOLDnet Projekts genehmigt. Ebenso wurde das Datenschutzkonzept genehmigt.
Die Ethikkommission der Ludwig Maximilians Univerität München hat der Teilnahme am GOLDnet Projekt zugestimmt.
- EK Gießen: Zustimmung des Projekts als .pdf
- EK München: Zustimmung Mitwirkung am Projekt als .pdf
Diagnostikalgorithmen für Standardsituationen*
* Alle diagnostischen Teste sind im Rahmen des Registers verfügbar
Reifes Neugeborenes, unklares Atemnotsyndrom, radiologisch diffus parenchymatöse Lungenerkrankung
Genetik für SFTPB, SFTPC, ABCA3*, TTF1
Biochemische Analyse der hydrophoben Surfactantproteine in der BAL, gewonnen vor exogener Surfactant-Gabe
* falls SFTPB und SFTPC negativ und fortbestehender der Klinik
Histologie mit specifischer Färbung für SP-B, pro-SP-B, pro-SP-C, TTF1, ABCA3 und andere
Säugling, Kleinkind, Schulkind, Jugendlicher oder Erwachsener mit Verdacht einer chronisch-interstitiellen Lungenerkrankung
Biochemische Analyse der hydrophoben Surfactantproteine in der BAL
Cytopreps gefärbt für PAS, Fe, LLM, MGG
Genetik für SFTPC, ABCA3*, TTF1, SFTPA2**, Telomerase**
* falls SFTPB und SFTPC negativ, weiterbestehende klinische Symptome
** aktuell nur Forschung
Histologie mit specifischer Färbung für SP-B, pro-SP-B, pro-SP-C, TTF1, ABCA3 und andere
Säugling, Kleinkind mit Verdacht auf chronische Tachypnoe
Biochemische Analyse der hydrophoben Surfactantproteine in der BAL
Urin für Bombesin
BAL-Cytopreps gefärbt für PAS, Fe, LLM, MGG
Genetik für SFTPC, ggf ABCA3, TTF1
Histologie mit specifischer Färbung für Bombesin, SP-B, pro-SP-B, pro-SP-C, TTF1, ABCA3 und andere
Neugeborenes, Säugling, Kleinkind, Schulkind, Jugendlicher oder Erwachsener mit Verdacht auf Alveolarproteinose
Serumanalyse von anti-GMCSF-Autoantikörper, GMCSF Spiegel, Serum- und Urinaminosäureprofil
Biochemische Analyse der hydrophoben Surfactantproteine in der BAL
BAL-Cytopreps gefärbt für PAS, Fe, LLM, MGG
Genetik für GMCSF-Ra, GMCSF-Rb, SFTPC, NPC2, Lysinurische Proteinurie, andere Kandidatengene
Histologie mit spezifischer Färbung für SP-A, SP-B, pro-SPC. TTF1, u.a.
Verlaufsbeobachtung: Serum SP-D, LDH
Urin
Einverständniserklärung für Kontrollen (inkl. Anleitung) als pdf.
Indikation: Alle Säuglinge mit chronischer Tachypnoe unbekannter Ursache
Urinprobengewinnung:
Urinporben werden gewonnen als Beutelurin oder Spontanurin, am besten Morgenurin, und mit Essigacetat angesäuert (Endkonzentration 2 N).
Hinzufügen von Essigacetat:
5ml Urin plus 5ml Essigacetat 25%
Berechnung: 1 molare Essigaectat-Lösung enthält 60g/l, somit entspricht 2N (2 normal) = 12g/100ml
a) 60 % Essigacetat-Lsg. enthält 60g/100ml, entsprechend 12g/20ml. In diesem Fall muss man 80 ml Urin 20ml 60% Essigacetat-Lsg. hinzufügen.
b) 25% Essigacetat-Lsg. enthält 25g/100ml, entsprechend 12,5g/50ml. In diesem Fall fügt man zu 50ml Urin 50ml 25% Essigacetat-Lsg. hinzu.
Anschließend muss die Probe bei -20°C eingefroren werden (nur für kurze Zeit), anschließend wird die Probe bei -80°C gelagert. Bei -80°C ist eine Langzeitlagerung möglich, die Probe jedoch muss auf Trockeneis verschickt werden.
Lassen Sie uns bitte auch eine Urinprobe eines gesunden Kindes als Kontrolle zukommen, damit wir eventuelle Einflüsse von Transport und Lagerung korrigieren können. Eine entsprechende Einverständniserklärung finden Sie in dem oben stehenden PDF-Dokument.
Literatur:
Cutten et al2002, ARJCCM.Urine Bombesin-like Peptide Elevation Precedes Clinical Evidence of Bronchopulmonary Dysplasia. Method: Urine was squeezed into a 2-ml tube with acetic acid (final concentration 2 N). Urine specimens were frozen for up to 6 hours at -20 C (greater than 90% BLP recovery), then cooled to -80 C (BLP indefinitely stable) until analyzed (within 12 months of being collected)